




《微专题3溶解度及溶解度曲线的应用PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为3.12 MB,总共有26页,格式为pptx。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 26页
- 3.12 MB
- VIP模板
- pptx
- 数字产品不支持退货
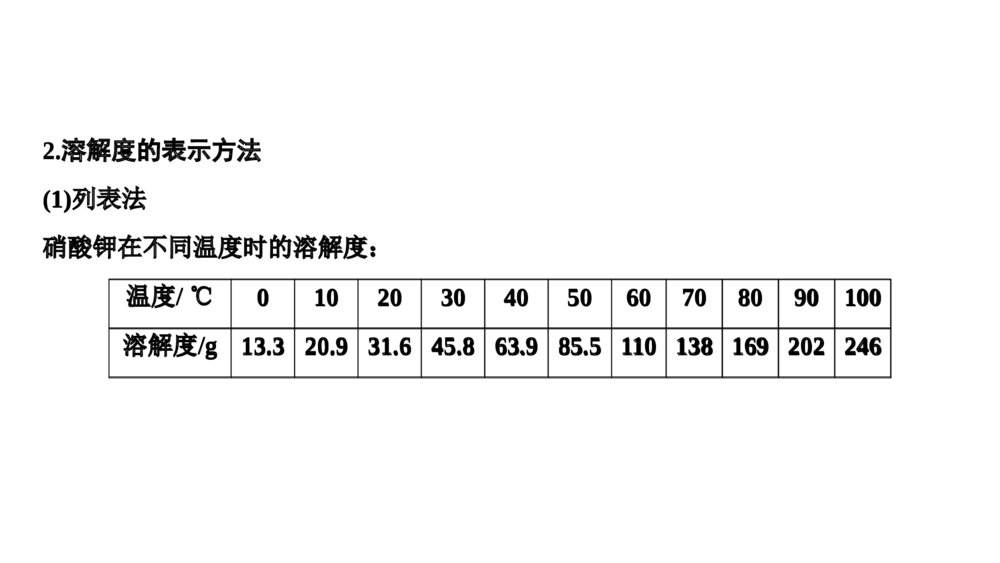
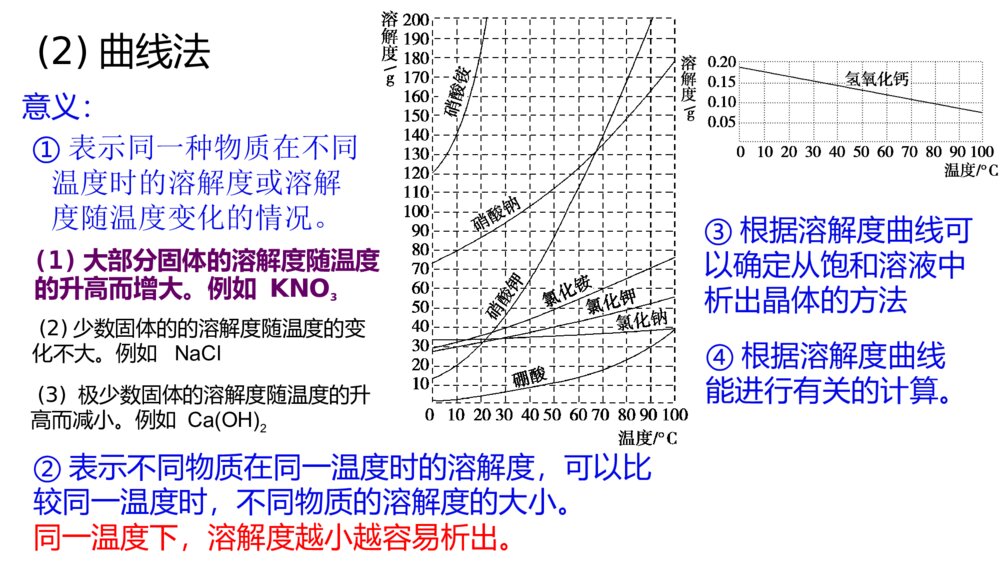
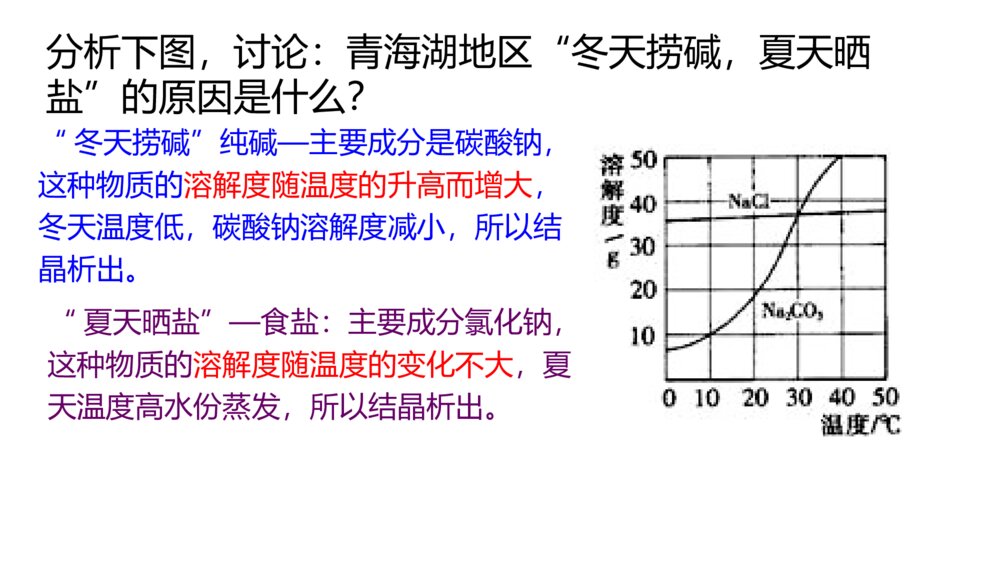
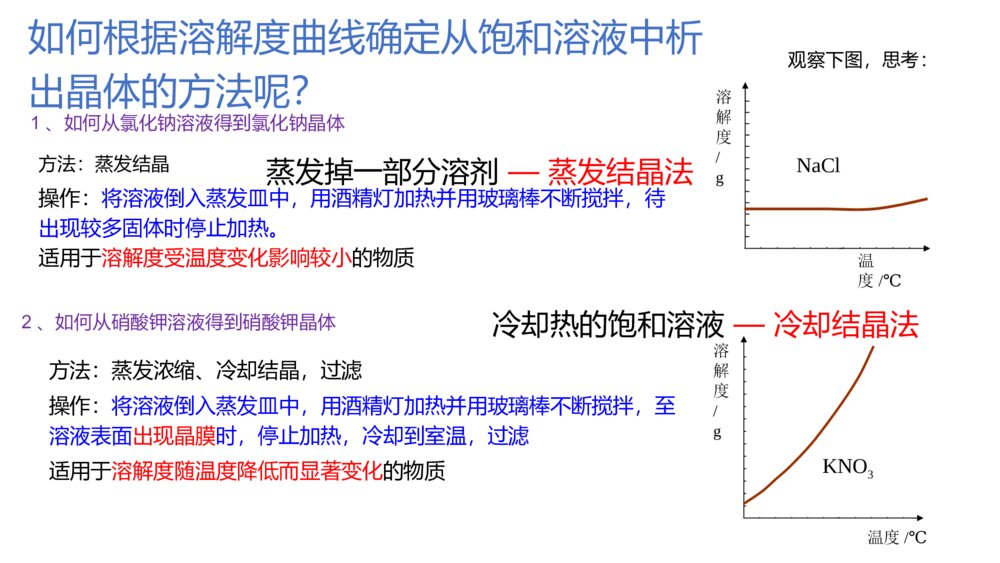
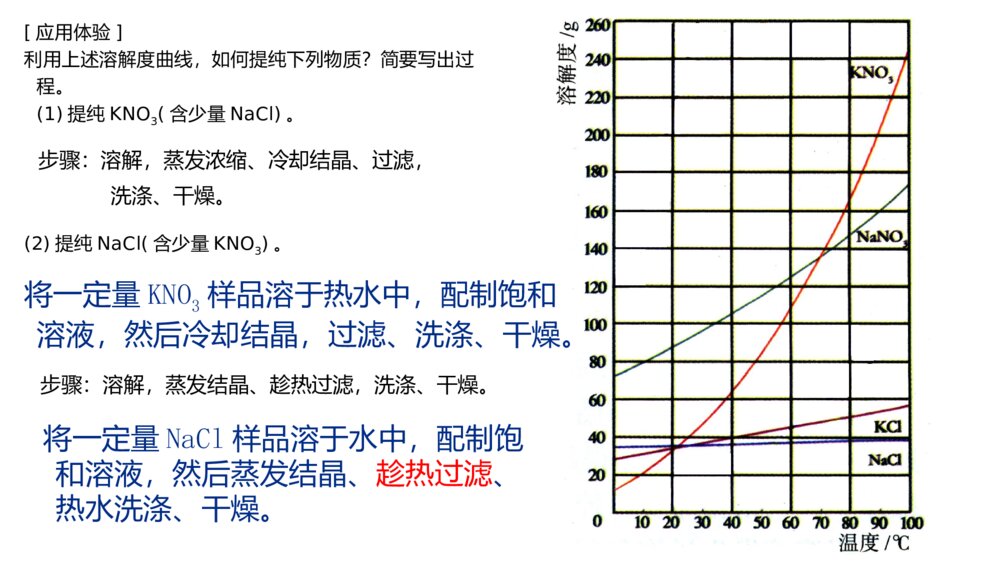
微专题溶解度及溶解度曲线的应用核心要点归纳1.溶解度概念:在一定温度下,某固体物质在100g溶剂(通常是水)里达到饱和状态时所溶解的质量,叫作这种物质在该溶剂里的溶解度,其单位为“g”公式:S=m溶质m溶剂×100g固体的溶解度影响因素:①溶剂的影响:如NaCl易溶于水不溶于汽油。②温度的影响:升高温度,大多数固体物质的溶解度增大,少数物质却相反,如Ca(OH)2;温度对NaCl的溶解度影响不大微专题溶解度及溶解度曲线的应用核心要点归纳1.溶解度概念:在一定温度下,某固体物质在100g溶剂(通常是水)里达到饱和状态时所溶解的质量,叫作这种物质在该溶剂里的溶解度,其单位为“g”公式:S=m溶质m溶剂×100g固体的溶解度影响因素:①溶剂的影响:如NaCl易溶于水不溶于汽油。②温度的影响:升高温度,大多数固体物质的溶解度增大,少数物质却相反,如Ca(OH)2;温度对NaCl的溶解度影响不大概念:通常指该气体(其压强为101kPa)在一定温度时溶解于1体积水里达到饱和状态时气体的体积,常记为1∶x。如NH3、HCl、SO2、CO2等气体常温时的溶解度分别为1∶700、1∶500、1∶40、1∶1气体的溶解度影响因素:气体溶解度的大小与温度和压强有关,温度升高,溶解度减小;压强增大,溶解度增大概念:通常指该气体(其压强为101kPa)在一定温度时溶解于1体积水里达到饱和状态时气体的体积,常记为1∶x。如NH3、HCl、SO2、CO2等气体常温时的溶解度分别为1∶700、1∶500、1∶40、1∶1气体的溶解度影响因素:气体溶解度的大小与温度和压强有关,温度升高,溶解度减小;压强增大,溶解度增大2.溶解度的表示方法(1)列表法硝酸钾在不同温度时的溶解度:温度/℃0102030405060708090100溶解度/g13.320.931.645.863.985.51101381692022462.溶解度的表示方法(1)列表法硝酸钾在不同温度时的溶解度:温度/℃0102030405060708090100溶解度/g13.320.931.645.863.985.5110138169202246意义:(1)大部分固体的溶解度随温度的升高而增大。例如KNO3(2)少数固体的的溶解度随温度的变化不大。例如NaCl(3)极少数固体的溶解度随温度的升高而减小。例如Ca(OH)2①表示同一种物质在不同温度时的溶解度或溶解度随温度变化的情况。②表示不同物质在同一温度时的溶解度,可以比较同一温度时,不同物质的溶解度的大小。同一温度下,溶解度越小越容易析出。③根据溶解度曲线可以确定从饱和溶液中析出晶体的方法④根据溶解度曲线能进行有关的计算。(2)曲线法分析下图,讨论:青海湖地区“冬天捞碱,夏天晒盐”的原因是什么?“夏天晒盐”—食盐:主要成分氯化钠,这种物质的溶解度随温度的变化不大,夏天温度高水份蒸发,所以结晶析出。“冬天捞碱”纯碱—主要成分是碳酸钠,这种物质的溶解度随温度的升高而增大,冬天温度低,碳酸钠溶解度减小,所以结晶析出。观察下图,思考:1、如何从氯化钠溶液得到氯化钠晶体溶解度/g温度/℃KNO32、如何从硝酸钾溶液得到硝酸钾晶体溶解度/g温度/℃NaCl方法:蒸发结晶操作:将溶液倒入蒸发皿中,用酒精灯加热并用玻璃棒不断搅拌,待出现较多固体时停止加热。适用于溶解度受温度变化影响较小的物质方法:蒸发浓缩、冷却结晶,过滤操作:将溶液倒入蒸发皿中,用酒精灯加热并用玻璃棒不断搅拌,至溶液表面出现晶膜时,停止加热,冷却到室温,过滤适用于溶解度随温度降低而显著变化的物质如何根据溶解度曲线确定从饱和溶液中析出晶体的方法呢?蒸发掉一部分溶剂—蒸发结晶法冷却热的饱和溶液—冷却结晶法[应用体验]利用上述溶解度曲线,如何提纯下列物质?简要写出过程。(1)提纯KNO3(含少量NaCl)。(2)提纯NaCl(含少量KNO3)。将一定量KNO3样品溶于热水中,配制饱和溶液,然后冷却结晶,过滤、洗涤、干燥。将一定量NaCl样品溶于水中,配制饱和溶液,然后蒸发结晶、趁热过滤、热水洗涤、干燥。步骤:溶解,蒸发浓缩、冷却结晶、过滤,洗涤、干燥。步骤:溶解,蒸发结晶、趁热过滤,洗涤、干燥。【小结】:解题方法、思路1、若得到的物质溶解度受温度的影响很小,如NaCl方法:蒸发结晶若是有杂质(如KNO3):蒸发结晶、趁热过滤,洗涤,干燥。2、若得到的物质溶解度受温度的影响较大,如KNO3方法:蒸发浓缩(至有晶膜出现)、冷却结晶、过滤,洗涤、干燥。专题突破训练1.请填写下列物质的结晶方法(1)氯化钠:_______________________________________________________。(2)硝酸钾:_______________________________________________________。(3)硫酸铜晶体:___________________________________________________。(4)从FeCl3溶液中得到FeCl3·6H2O固体:___________________________________________________________________________________________________。专题突破训练1.请填写下列物质的结晶方法(1)氯化钠:_______________________________________________________。(2)硝酸钾:_______________________________________________________。(3)硫酸铜晶体:___________________________________________________。(4)从FeCl3溶液中得到FeCl3·6H2O固体:___________________________________________________________________________________________________。答案:(1)蒸发结晶(2)蒸发浓缩、冷却结晶(3)蒸发浓缩、冷却结晶(4)在HCl气氛中加热,蒸发结晶答案:(1)蒸发结晶(2)蒸发浓缩、冷却结晶(3)蒸发浓缩、冷却结晶(4)在HCl气氛中加热,蒸发结晶2.如图是X、Y、Z三种固体物质的溶解度曲线。按要求回答下列问题:(1)若X溶液中混有少量Y,怎样提纯X?___________________________________________________________________。(2)若Y溶液中混有少量的X,怎样提纯Y?__________________________________________________________________。答案:(1)加热浓缩,冷却结晶,过滤(2)蒸发结晶,趁热过滤2.如图是X、Y、Z三种固体物质的溶解度曲线。按要求回答下列问题:(1)若X溶液中混有少量Y,怎样提纯X?___________________________________________________________________。(2)若Y溶液中混有少量的X,怎样提纯Y?__________________________________________________________________。答案:(1)加热浓缩,冷却结晶,过滤(2)蒸发结晶,趁热过滤3.已知四种盐的溶解度(S)曲线如图所示,下列说法不正确的是()A.将NaCl溶液蒸干可得NaCl固体B.将MgCl2溶液蒸干可得MgCl2固体C.Mg(ClO3)2中混有少量NaCl杂质,可用重结晶法提纯D.可用MgCl2和NaClO3制备Mg(ClO3)2答案:B3.已知四种盐的溶解度(S)曲线如图所示,下列说法不正确的是()A.将NaCl溶液蒸干可得NaCl固体B.将MgCl2溶液蒸干可得MgCl2固体C.Mg(ClO3)2中混有少量NaCl杂质,可用重结晶法提纯D.可用MgCl2和NaClO3制备Mg(ClO3)2答案:B4.下表是四种盐在不同温度下的溶解度(g/100g水):(假设:盐类共存时不影响各自的溶解度,分离晶体时,溶剂的损耗忽略不计)NaNO3KNO3NaClKCl10℃80.521.235.731.0100℃17524639.156.6用物质的量之比为1∶1的硝酸钠和氯化钾为原料,制取硝酸钾晶体,其流程如图所示4.下表是四种盐在不同温度下的溶解度(g/100g水):(假设:盐类共存时不影响各自的溶解度,分离晶体时,溶剂的损耗忽略不计)NaNO3KNO3NaClKCl10℃80.521.235.731.0100℃17524639.156.6用物质的量之比为1∶1的硝酸钠和氯化钾为原料,制取硝酸钾晶体,其流程如图所示以下说法错误的是()A.①和②的实验过程中,都需要控制温度B.①实验操作依次为加水溶解、蒸发浓缩结晶、趁热过滤C.②实验操作依次为加水溶解、蒸发浓缩结晶、趁热过滤D.用95%的酒精洗涤所得的硝酸钾晶体比较好解析:A项,①中含有的蒸发浓缩过程与②中的冷却结晶,均需要控制温度,正确;B项,①实验分离出NaCl,操作依次为加水溶解、蒸发浓缩、趁热过滤,正确;C项,②实验操作为冷却结晶,错误;D项,用95%的酒精洗涤所得的硝酸钾晶体比较好,可减少硝酸钾的溶解,正确。答案:C以下说法错误的是()A.①和②的实验过程中,都需要控制温度B.①实验操作依次为加水溶解、蒸发浓缩结晶、趁热过滤C.②实验操作依次为加水溶解、蒸发浓缩结晶、趁热过滤D.用95%的酒精洗涤所得的硝酸钾晶体比较好解析:A项,①中含有的蒸发浓缩过程与②中的冷却结晶,均需要控制温度,正确;B项,①实验分离出NaCl,操作依次为加水溶解、蒸发浓缩、趁热过滤,正确;C项,②实验操作为冷却结晶,错误;D项,用95%的酒精洗涤所得的硝酸钾晶体比较好,可减少硝酸钾的溶解,正确。答案:C5.重铬酸钾(K2Cr2O7)是一种重要的氧化剂。某Cr2O3样品中含有少量Al2O3、MgO等杂质。实验室以此样品为主要原料制取K2Cr2O7,相关流程及物质溶解度曲线如下:5.重铬酸钾(K2Cr2O7)是一种重要的氧化剂。某Cr2O3样品中含有少量Al2O3、MgO等杂质。实验室以此样品为主要原料制取K2Cr2O7,相关流程及物质溶解度曲线如下:已知:2CrO2-4+2H+Cr2O2-7+H2O操作X包含________________________________________________________。答案:冷却结晶、过滤、冰水洗涤、干燥已知:2CrO2-4+2H+Cr2O2-7+H2O操作X包含________________________________________________________。答案:冷却结晶、过滤、冰水洗涤、干燥6.高氯酸铵可用作火箭推进剂,实验室可由NaClO3等原料制取(部分物质溶解度如图),其实验流程如下:6.高氯酸铵可用作火箭推进剂,实验室可由NaClO3等原料制取(部分物质溶解度如图),其实验流程如下:(已知氯酸钠受热分解生成高氯酸钠和氯化钠)(1)将80℃时的浸取液冷却至0℃过滤,滤渣的主要成分为____________________(写化学式)。(2)反应器中加入氯化铵饱和溶液发生反应的离子方程式为__________________________________________________________________。(已知氯酸钠受热分解生成高氯酸钠和氯化钠)(1)将80℃时的浸取液冷却至0℃过滤,滤渣的主要成分为____________________(写化学式)。(2)反应器中加入氯化铵饱和溶液发生反应的离子方程式为__________________________________________________________________。解析:(1)80℃时浸取液主要含有NaClO4和NaCl,NaClO4溶解度受温度影响较大,而NaCl受温度影响很小,当冷却至0℃时,NaClO4会因温度降低溶解度减小而析出,所以滤渣中主要物质是NaClO4。(2)反应器中含有NaClO4,加入氯化铵饱和溶液后,根据不同物质的溶解度相对大小关系,可知溶解度最小的NH4ClO4首先结晶析出,发生反应的离子方程式为NH+4+ClO-4===NH4ClO4↓。答案:(1)NaClO4(2)NH+4+ClO-4===NH4ClO4↓解析:(1)80℃时浸取液主要含有NaClO4和NaCl,NaClO4溶解度受温度影响较大,而NaCl受温度影响很小,当冷却至0℃时,NaClO4会因温度降低溶解度减小而析出,所以滤渣中主要物质是NaClO4。(2)反应器中含有NaClO4,加入氯化铵饱和溶液后,根据不同物质的溶解度相对大小关系,可知溶解度最小的NH4ClO4首先结晶析出,发生反应的离子方程式为NH+4+ClO-4===NH4ClO4↓。答案:(1)NaClO4(2)NH+4+ClO-4===NH4ClO4↓[做真题·对接高考]探明考向提升考能1.正误判断,正确的打“√”,错误的打“×”(1)(2018·全国高考卷Ⅱ)实验目的实验过程评价配制0.4000mol·L-1的NaOH溶液称取4.0g固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至250mL容量瓶中定容[做真题·对接高考]探明考向提升考能1.正误判断,正确的打“√”,错误的打“×”(1)(2018·全国高考卷Ⅱ)实验目的实验过程评价配制0.4000mol·L-1的NaOH溶液称取4.0g固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至250mL容量瓶中定容(2)(2017·全国高考卷Ⅲ)目的操作评价配制浓度为0.010mol·L-1的KMnO4溶液称取KMnO4固体0.158g,放入100mL容量瓶中,加水溶解并稀释至刻度答案:(1)×(2)×(2)(2017·全国高考卷Ⅲ)目的操作评价配制浓度为0.010mol·L-1的KMnO4溶液称取KMnO4固体0.158g,放入100mL容量瓶中,加水溶解并稀释至刻度答案:(1)×(2)×2.(2015·山东高考卷)实验室用37%的盐酸配制15%的盐酸,除量筒外还需要用下列仪器中的_______。a.烧杯b.容量瓶c.玻璃棒d.滴定管答案:ac2.(2015·山东高考卷)实验室用37%的盐酸配制15%的盐酸,除量筒外还需要用下列仪器中的_______。a.烧杯b.容量瓶c.玻璃棒d.滴定管答案:ac3.(2016·全国高考卷Ⅱ)一种双氧水的质量分数为27.5%(密度为1.10g·cm-3),其浓度为________mol·L-1。答案:8.93.(2016·全国高考卷Ⅱ)一种双氧水的质量分数为27.5%(密度为1.10g·cm-3),其浓度为________mol·L-1。答案:8.94.(2017·江苏高考卷)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O。为测定某碱式氯化铜的组成,进行下列实验:①称取样品1.1160g,用少量稀HNO3溶解后配成100.00mL溶液A;②取25.00mL溶液A,加入足量AgNO3溶液,得AgCl0.1722g;③另取25.00mL溶液A,调节pH4~5,用浓度为0.08000mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+(离子方程式为Cu2++H2Y2-===CuY2-+2H+),滴定至终点,消耗标准溶液30.00mL。通过计算确定该样品的化学式(写出计算过程)。4.(2017·江苏高考卷)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O。为测定某碱式氯化铜的组成,进行下列实验:①称取样品1.1160g,用少量稀HNO3溶解后配成100.00mL溶液A;②取25.00mL溶液A,加入足量AgNO3溶液,得AgCl0.1722g;③另取25.00mL溶液A,调节pH4~5,用浓度为0.08000mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+(离子方程式为Cu2++H2Y2-===CuY2-+2H+),滴定至终点,消耗标准溶液30.00mL。通过计算确定该样品的化学式(写出计算过程)。答案:n(Cl-)=n(AgCl)×100.00mL25.00mL=0.1722g143.5g·mol-1×100.00mL25.00mL=4.800×10-3mol,n(Cu2+)=n(EDTA)×100.00mL25.00mL=0.08000mol·L-1×30.00mL×10-3L·mL-1×100.00mL25.00mL=9.600×10-3mol,n(OH-)=2n(Cu2+)-n(Cl-)=2×9.600×10-3mol-4.800×10-3mol=1.440×10-2mol。答案:n(Cl-)=n(AgCl)×100.00mL25.00mL=0.1722g143.5g·mol-1×100.00mL25.00mL=4.800×10-3mol,n(Cu2+)=n(EDTA)×100.00mL25.00mL=0.08000mol·L-1×30.00mL×10-3L·mL-1×100.00mL25.00mL=9.600×10-3mol,n(OH-)=2n(Cu2+)-n(Cl-)=2×9.600×10-3mol-4.800×10-3mol=1.440×10-2mol。m(Cl-)=4.800×10-3mol×35.5g·mol-1=0.1704g,m(Cu2+)=9.600×10-3mol×64g·mol-1=0.6144g,m(OH-)=1.440×10-2mol×17g·mol-1=0.2448g。n(H2O)=1.1160g-0.1704g-0.6144g-0.2448g18g·mol-1=4.800×10-3mol,a∶b∶c∶x=n(Cu2+)∶n(OH-)∶n(Cl-)∶n(H2O)=2∶3∶1∶1,化学式为Cu2(OH)3Cl·H2O。m(Cl-)=4.800×10-3mol×35.5g·mol-1=0.1704g,m(Cu2+)=9.600×10-3mol×64g·mol-1=0.6144g,m(OH-)=1.440×10-2mol×17g·mol-1=0.2448g。n(H2O)=1.1160g-0.1704g-0.6144g-0.2448g18g·mol-1=4.800×10-3mol,a∶b∶c∶x=n(Cu2+)∶n(OH-)∶n(Cl-)∶n(H2O)=2∶3∶1∶1,化学式为Cu2(OH)3Cl·H2O。



















